Cell Reports:杜美蓉团队揭示CD36介导蜕膜基质细胞与巨噬细胞脂质交流在早期妊娠失败中的关键机制
来源:生物探索 2024-11-11 09:50
该研究不仅揭示了CD36介导的AA胞间转运在自然流产发病中的作用,还寻找到内源性激素PRL在抑制AA转运中的保护性机制,揭示了妊娠特征性“内分泌-代谢-免疫”调控轴。
作为妊娠期子宫蜕膜的主要功能细胞,基质细胞与免疫细胞频繁互作,共同维持母胎界面的免疫平衡,有利于妊娠的建立和维持。研究表明,蜕膜组织富含大量糖原、脂滴等成分,显示出活跃的糖脂代谢【1,2】。与未孕子宫的内膜基质细胞相比,蜕膜基质细胞中的脂滴数量显著增多【3】。同时,近期多项临床研究表明,母体血清脂质成分的变化与自然流产的发生密切相关【4,5】,提示脂代谢异常可能是不良妊娠结局的潜在致病因素之一。巨噬细胞的表型和功能受微环境中代谢信号的影响和调控,然而目前尚不清楚自然流产时蜕膜组织是否存在脂代谢异常,以及基质细胞与巨噬细胞之间的脂质交流如何影响其免疫功能转化并介导早期妊娠失败的具体机制。
复旦大学附属妇产科医院杜美蓉团队在Cell Reports杂志上在线发表了题为CD36-mediated arachidonic acid influx from decidual stromal cells increases inflammatory macrophages in miscarriage的研究论文。研究发现,自然流产蜕膜组织中脂滴蓄积,基质细胞与巨噬细胞脂代谢异常活跃。巨噬细胞高表达CD36,介导花生四烯酸(AA)从基质细胞向巨噬细胞的转运,促进巨噬细胞生成IL-1β,从而诱发免疫炎症反应。同时揭示了催乳素(PRL)能够抑制上述脂质转运过程,在正常妊娠时作为保护因子防止脂质过度累积的调控机制。

研究人员首先在不明原因自然流产患者的蜕膜组织冰冻切片中观察到大量脂滴累积的现象,并在构建的三种不同自然流产小鼠模型中均证实了这一现象。通过单细胞测序分析发现,自然流产蜕膜组织的主要细胞类型,尤其是基质细胞和巨噬细胞,脂代谢水平显著增强。脂质染色定量结果表明,基质细胞在所有蜕膜细胞中脂质含量最高。利用代谢分析软件MEBOCOST计算发现,自然流产时基质细胞与巨噬细胞之间的代谢互作增强。脂质示踪染色进一步证实,自然流产时基质细胞向巨噬细胞的脂质转运显著增加。进一步研究发现CD36是介导这一脂质转运的关键受体,脂质组学分析鉴定出AA是主要被转运的脂质。花生四烯酸靶向脂质组学揭示,基质细胞来源的AA通过CD36进入巨噬细胞,并在环氧合酶COX2作用下分解为前列腺素PGE2,后者通过自分泌机制作用于其受体,促进IL-1β的生成,增强巨噬细胞的炎症表型,从而破坏母胎界面免疫耐受,最终导致早期妊娠失败。条件性敲除巨噬细胞Cd36显著降低AA诱导的胚胎吸收率。
研究人员进一步发现,基质细胞来源的PRL能有效抑制巨噬细胞CD36的表达,从而抑制AA转运引发的免疫炎症。PRL是基质细胞蜕膜化的标志物,然而在自然流产中,基质细胞蜕膜化不良可能导致PRL分泌不足,从而无法有效抑制CD36介导的AA转运。通过孟德尔随机化分析,研究还发现母体血清PRL水平与自然流产的发生呈负相关。这些结果提示,正常妊娠时基质细胞通过PRL的自控机制防止异常脂代谢互作,从而维持免疫耐受微环境。
综上所述,该研究不仅揭示了CD36介导的AA胞间转运在自然流产发病中的作用,还寻找到内源性激素PRL在抑制AA转运中的保护性机制,揭示了妊娠特征性“内分泌-代谢-免疫”调控轴,为进一步理解脂质代谢紊乱与自然流产的关系提供了新的思路和见解。
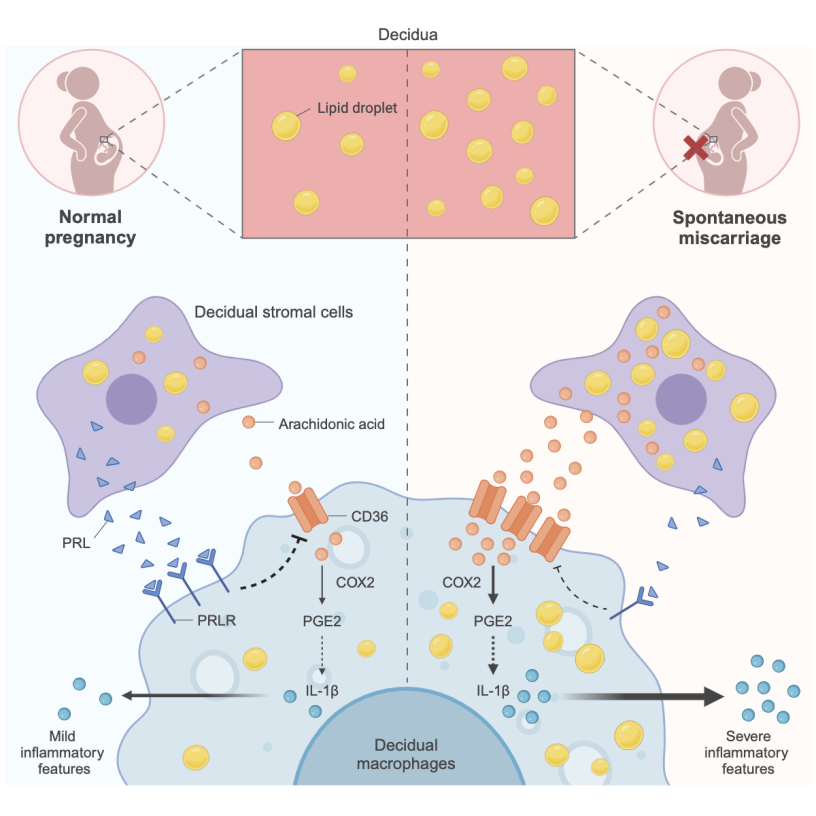
模式图(Credit: Cell Reports)
参考文献
1. Wang, L.L., Liu, H., Zhao, S.J., Shen, L., Xie, T., Luo, J., Mor, G., and Liao,A.H. (2021). The metabolic landscape of decidua in recurrent pregnancy loss using a global metabolomics approach. Placenta 112, 45–53. https://doi.org/10.1016/j.placenta.2021.07.001.
2. Tamura, I., Fujimura, T., Doi-Tanaka, Y., Takagi, H., Shirafuta, Y., Kajimura, T., Mihara, Y., Maekawa, R., Taketani, T., Sato, S., et al. (2021). The essential glucose transporter GLUT1 is epigenetically upregulated by C/EBPb and WT1 during decidualization of the endometrium. J. Biol.Chem. 297, 101150. https://doi.org/10.1016/j.jbc.2021.101150.
3. Tamura, I., Takagi, H., Doi-Tanaka, Y., Shirafuta, Y., Mihara, Y., Shinagawa, M., Maekawa, R., Taketani, T., Sato, S., Tamura, H., and Sugino,N. (2020). Wilms tumor 1 regulates lipid accumulation in human endometrial stromal cells during decidualization. J. Biol. Chem. 295, 4673–4683. https://doi.org/10.1074/jbc.RA120.012841.
4. Liu, Y., Du, M., Gan, Y., Bao, S., Feng, L., and Zhang, J. (2021). Triglyceride Induced Metabolic Inflammation: Potential Connection of Insulin Resistance and Recurrent Pregnancy Loss. Front. Endocrinol. 12, 621845. https://doi.org/10.3389/fendo.2021.621845.
5. Kim, K., Browne, R.W., Nobles, C.J., Radin, R.G., Holland, T.L., Omosigho, U.R., Connell, M.T., Plowden, T.C., Wilcox, B.D., Silver, R.M.,et al. (2019). Associations Between Preconception Plasma Fatty Acids and Pregnancy Outcomes. Epidemiology 30, S37–S46. https://doi.org/10.1097/EDE.0000000000001066.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


